附属第一妇婴保健院刘志强团队揭示ClC-6结构功能及其突变导致儿童早发性神经退行性疾病的分子基础,研究成果发表于《科学进展》
来源:医学院
时间:2023-11-08 浏览:
近日,同济大学附属第一妇婴保健院麻醉科刘志强教授团队联合国内外多家著名机构,在Science子刊《科学进展》(Science Advances)发表题为“Molecular basis of ClC-6 function and its impairment in human disease”的研究论文。

同济大学附属第一妇婴保健院为论文第一单位。同济大学附属第一妇婴保健院张兵研究员、叶冰璐博士,清华大学张森森博士、易静波博士,德国莱布尼茨分子药理学研究所Maya M. Polovitskaya博士为论文共同第一作者。同济大学附属第一妇婴保健院刘志强教授,清华大学杨茂君教授,德国莱布尼茨分子药理学研究所Thomas J.Jentsch教授,中国科学院上海药物研究所李扬研究员,意大利IRCCS的Marco Tartaglia教授为论文共同通讯作者。华东理工大学李沅汐博士为研究提供了重要支持。
ClC-6是一种神经元特异性分布的Cl−/H+反向转运体。早在上世纪90年代ClC-6的cDNA即被克隆,但其功能研究进展较慢,主要原因是ClC-6于胞浆内膜系统分布,给电生理记录带来困难。另一方面,由于ClC-6充分激活依赖于极高的去极化电压,早期探索未能充分捕捉到ClC-6的重要基本特性。ClC-6的生理功能和致病的分子基础仍存在较大空白。
研究团队曾解析CLC家族蛋白ClC-7/Ostm1复合物的蛋白结构,并详尽阐述了ClC-7/Ostm1复合物的门控机制 (Sensen Zhang et al., Science Advances, 2020)。在前期研究基础上,该团队通过冷冻电镜技术首次解析了人源ClC-6的蛋白结构。与CLC家族其它成员相比,ClC-6蛋白C末端包含一段延长序列,该片段伸向对面CBS亚基内部,电生理功能研究证实该特殊片段重点参与ClC-6的门控过程。在ClC-6首次跨膜螺旋的起始端富集多个正电荷氨基酸(KKGRR),这些氨基酸能与周围磷脂分子形成互作,该结构特性是决定ClC-6能在细胞内特定亚区(晚期内体)定位的关键(图1)。
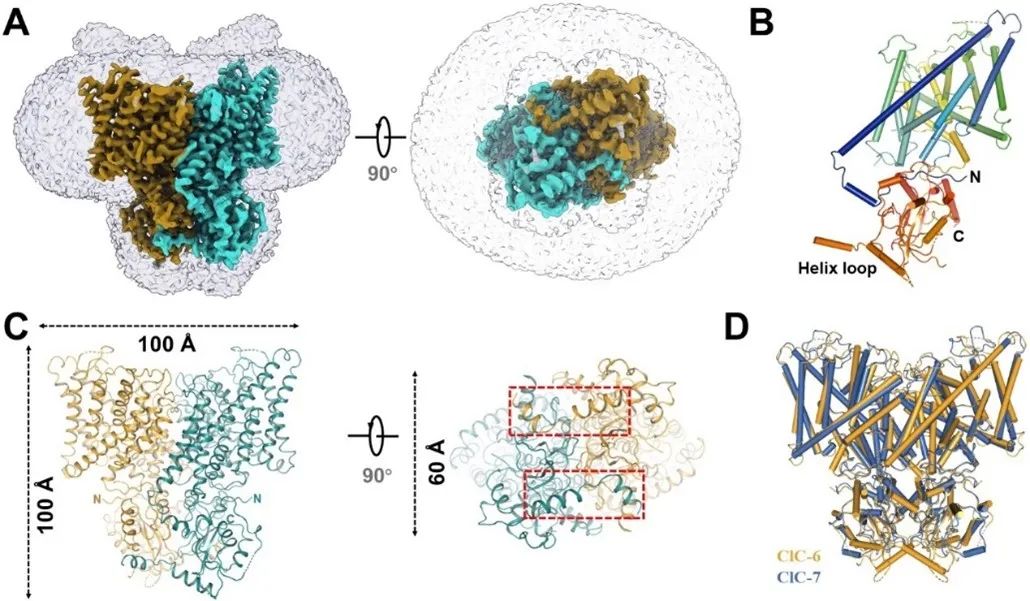
图1 人源ClC-6蛋白结构
为充分理解ClC-6功能,研究团队对ClC-6的基本电生理特性进行了描述(图2),并揭示了ATP结合口袋位于ClC-6胞内CBS亚基,ATP促进ClC-6电压依赖性,ATP结合缺失型突变导致ClC-6电压依赖性大幅降低。

图2 ClC-6的基本电生理特征
Thomas J. Jentsch教授团队于2020年报道了ClC-6 p.Y553C是导致儿童早发性神经退行性疾病的新发突变,该项研究首次建立了ClC-6功能异常与小儿神经发育缺陷性疾病之间的关联。但是,关于p.Y553C突变的致病机制尚不清楚,特别是Y553C为何能引起ClC-6电压敏感性增强的分子基础仍待阐明。刘志强教授团队发现Y553与F317和T520三者之间形成互作关系,此三位点任一突变均导致ClC-6电压敏感性明显增强,证明Y553/F317/T520构成的3D结构微网络是维系ClC-6电压敏感性的关键区域(图3)。

图3 Y553/F317/T520 3D结构微网络调控ClC-6电压敏感性
令人振奋的是,在功能研究获得进展的同时,研究团队收集到了一名携带p.T520A新发突变的临床病例,该患者出现发育迟缓和全身肌肉张力减退,MRI显示白质髓鞘形成不足和脊髓肿胀,整体表现与携带p.Y553C突变患者大致重叠。此项研究证明Y553/F317/T520 3D结构微网络是功能和致病的关键区域,该结构区域被破坏将导致严重早发性神经退行性疾病(图4)。
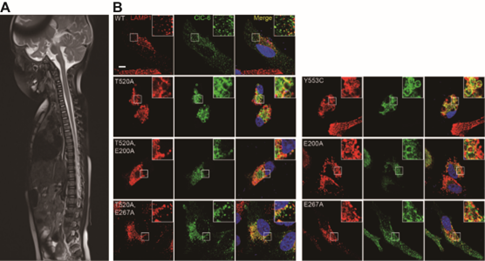
图4 ClC-6致病突变引起的临床和细胞生物学改变
Y553, F317和T520分别位于helix P/Q linker边缘,helix I/J linker和helix O上,Y553/F317/T520构成的3D微网络在功能和致病中的关键性,促使研究团队将研究拓展到它们对应的这三个结构片段。由Y553/F317/T520 3D的结构微网络出发,鉴定出多个调控CLCs门控过程的功能性结构片段,并将潜在致病位点延展到这些关键区域(图5)。

图5 Helix P/Q linker调节ClC-6电压敏感性的作用机制
该项研究较大程度地更新了对ClC-6结构与功能的认知,阐明了ClC-6突变导致儿童早发性神经退行性疾病的分子基础,并揭示了多个调控ClC-6门控过程的功能性结构片段,本研究涉及的功能性位点的序列保守性表明相关分子机制可推演到整个CLC家族蛋白。
论文链接:https://doi.org/10.1126/sciadv.adg4479